目录
快速导航-

教学研究 | 基于学科理解的“醛酮”教学设计实践与反思
教学研究 | 基于学科理解的“醛酮”教学设计实践与反思
-

教学研究 | 基于四重表征的观念建构“离子反应”教学
教学研究 | 基于四重表征的观念建构“离子反应”教学
-

教学研究 | 以高质量习题讲评增进化学学科理解
教学研究 | 以高质量习题讲评增进化学学科理解
-
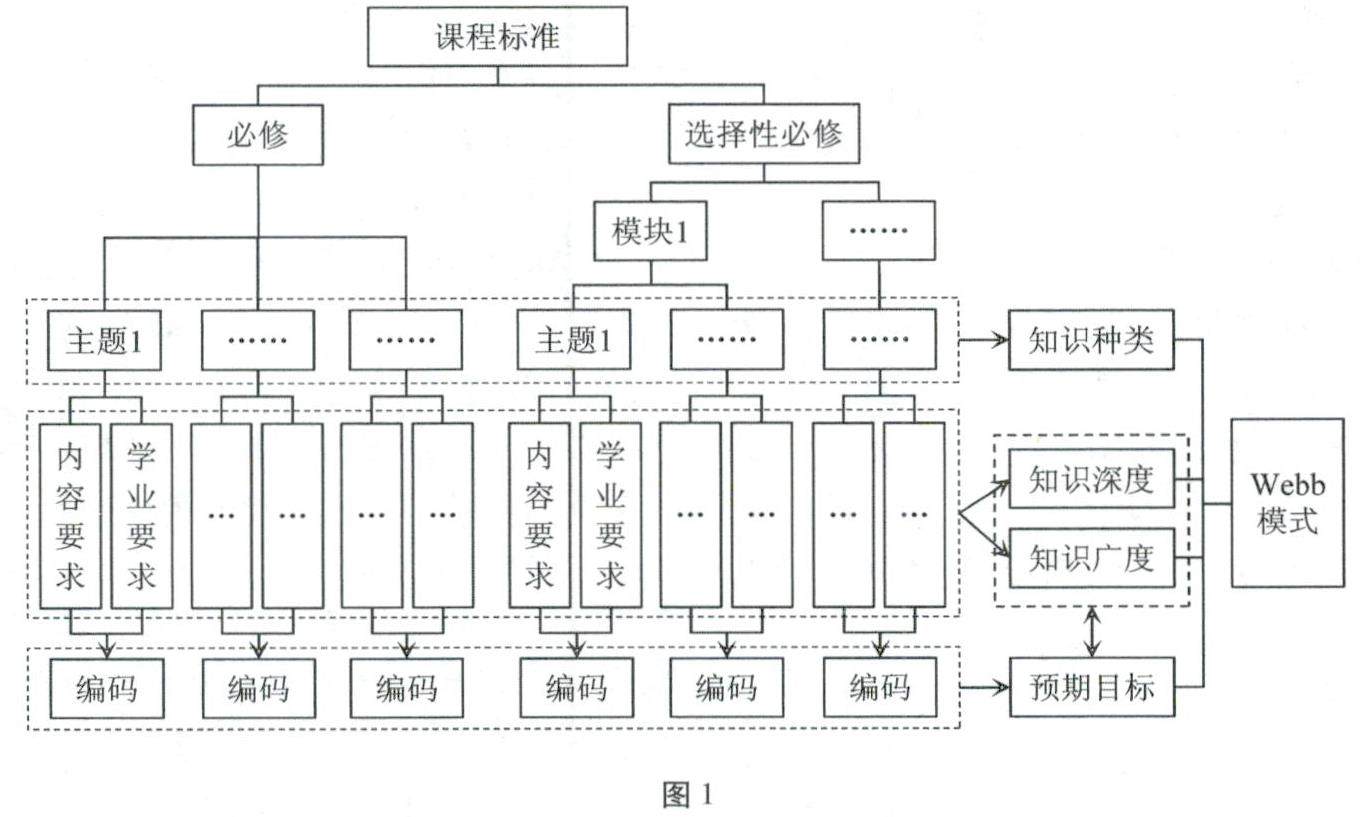
教学研究 | 普通高等学校招生选择性考试与课程标准的一致性研究
教学研究 | 普通高等学校招生选择性考试与课程标准的一致性研究
-
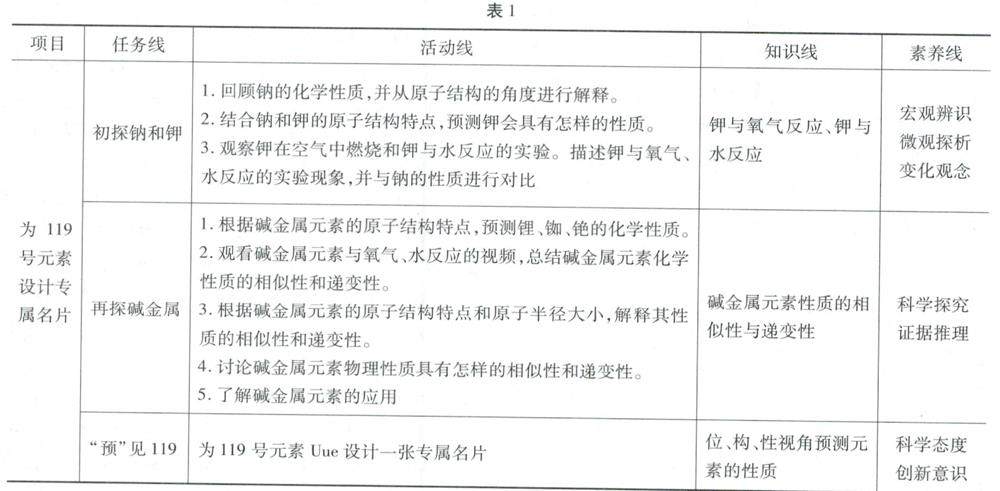
教学研究 | 高中化学“碱金属元素”的项目式教学实践
教学研究 | 高中化学“碱金属元素”的项目式教学实践
-
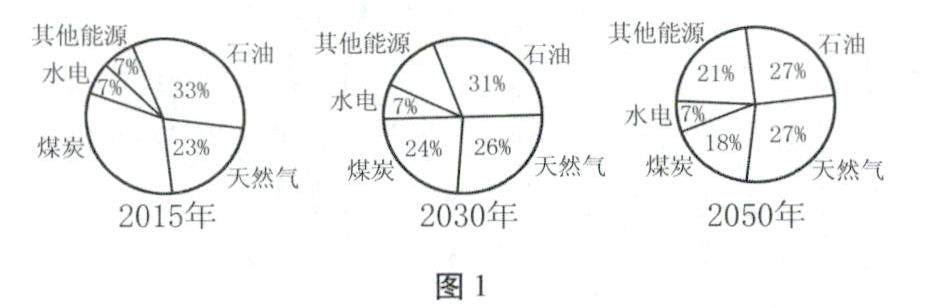
学习园地 | 燃料及其利用焦点解读
学习园地 | 燃料及其利用焦点解读
-
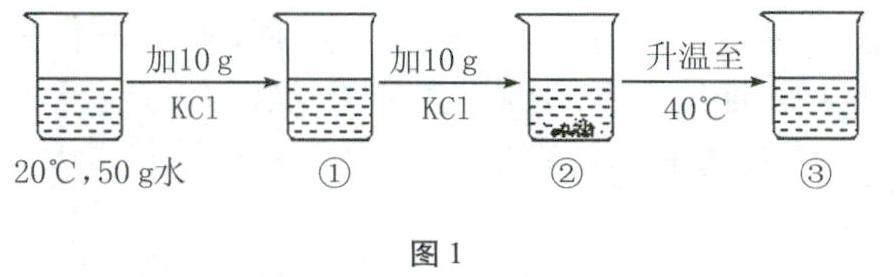
学习园地 | “溶液”知识点例析
学习园地 | “溶液”知识点例析
-
学习园地 | 也谈化学与人的健康
学习园地 | 也谈化学与人的健康
-
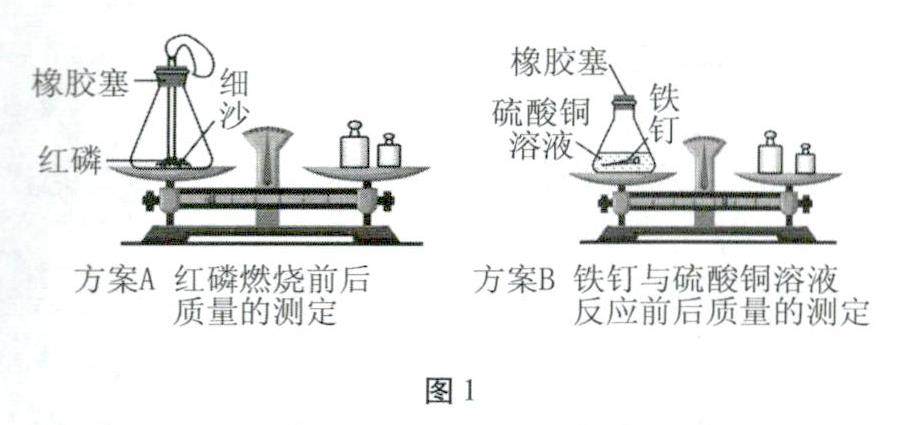
学习园地 | 质量守恒定律的理解与考查
学习园地 | 质量守恒定律的理解与考查
-

学习园地 | 聚焦酸的化学性质
学习园地 | 聚焦酸的化学性质
-
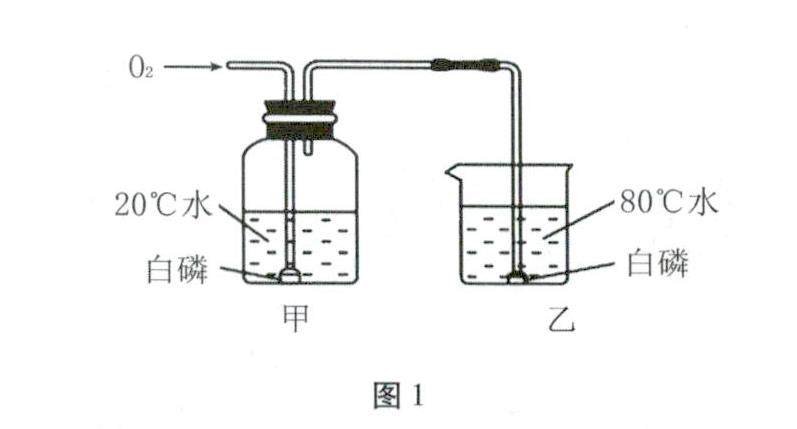
备课札记 | 中考化学实验考查的分类
备课札记 | 中考化学实验考查的分类
-

备课札记 | 盐类的水解应用多
备课札记 | 盐类的水解应用多
-

备课札记 | 书写电子式的常见错误例析
备课札记 | 书写电子式的常见错误例析
-
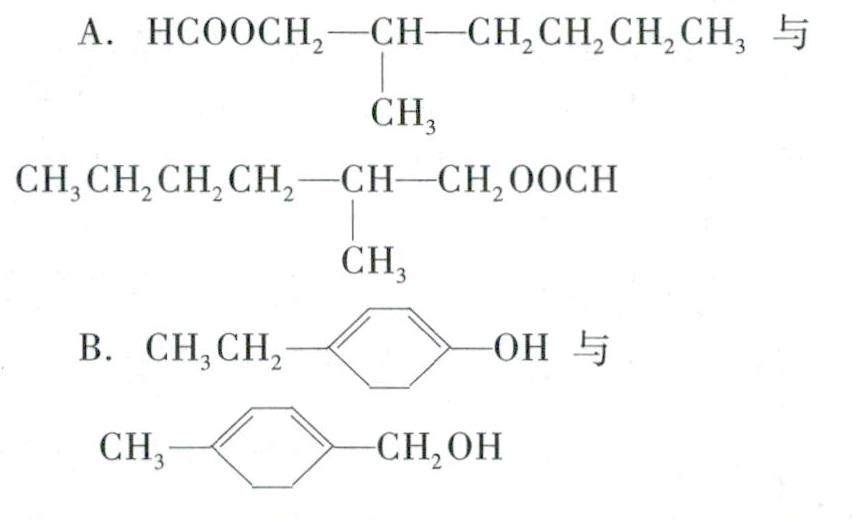
备课札记 | 也谈“同分异构体”的书写
备课札记 | 也谈“同分异构体”的书写
-
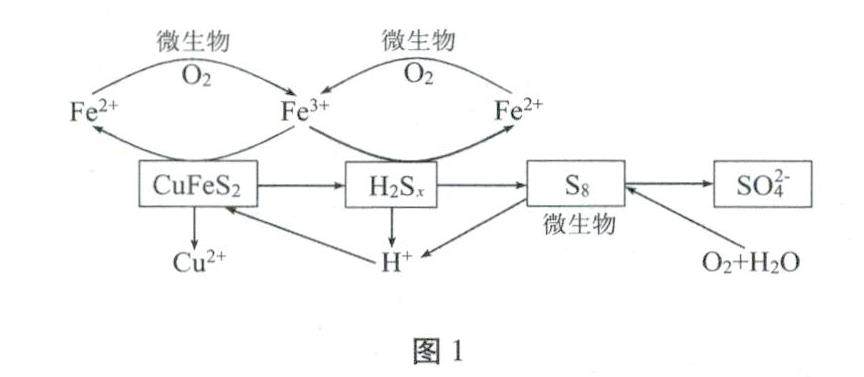
方法与技巧 | 例谈新情境下信息型氧化还原反应离子方程式的书写方法
方法与技巧 | 例谈新情境下信息型氧化还原反应离子方程式的书写方法
-
方法与技巧 | 突破中考化学推断题
方法与技巧 | 突破中考化学推断题
-

方法与技巧 | 例谈电荷守恒巧解试题
方法与技巧 | 例谈电荷守恒巧解试题
-
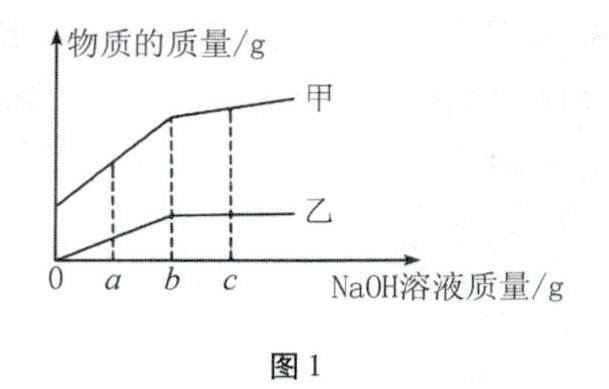
方法与技巧 | 中考化学坐标曲线题分类解析
方法与技巧 | 中考化学坐标曲线题分类解析
-

方法与技巧 | 浅议键角大小比较
方法与技巧 | 浅议键角大小比较
-

方法与技巧 | 巧用零基准法书写质子守恒式
方法与技巧 | 巧用零基准法书写质子守恒式
-

试题研究 | 硫及含硫化合物在2023年高考中的考查
试题研究 | 硫及含硫化合物在2023年高考中的考查
-

复习与练习 | 溶液pH速算规律及应用
复习与练习 | 溶液pH速算规律及应用
-
复习与练习 | 归纳法在初中化学解题中的应用
复习与练习 | 归纳法在初中化学解题中的应用
-

复习与练习 | “热化学方程式”知识揭秘
复习与练习 | “热化学方程式”知识揭秘
-
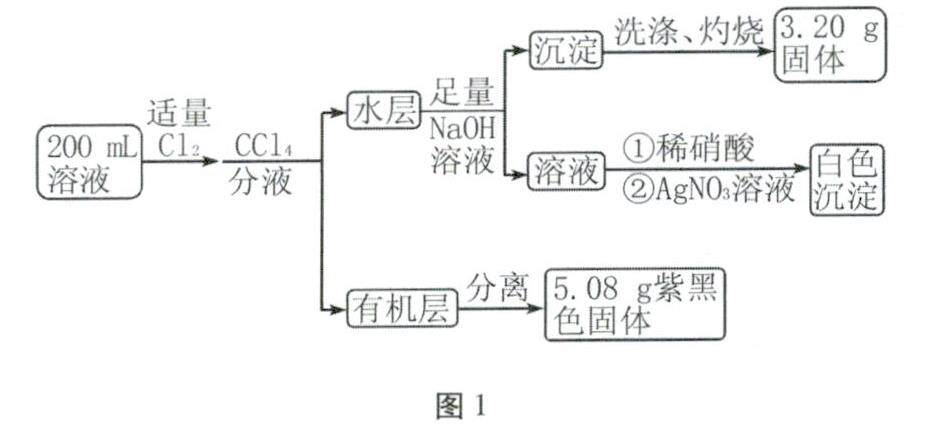
复习与练习 | 把握原则 赏析离子推断的分类
复习与练习 | 把握原则 赏析离子推断的分类
-
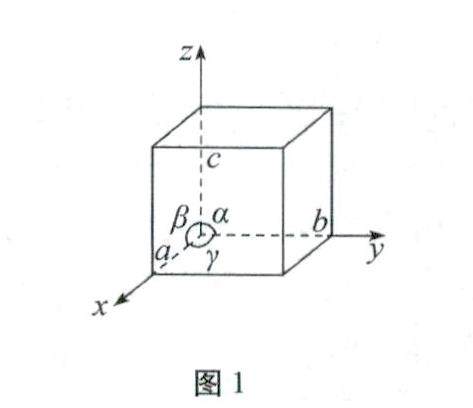
复习与练习 | 基于数形结合的晶胞复习
复习与练习 | 基于数形结合的晶胞复习
-

复习与练习 | 例谈电子层结构相同离子知识规律的应用
复习与练习 | 例谈电子层结构相同离子知识规律的应用
-
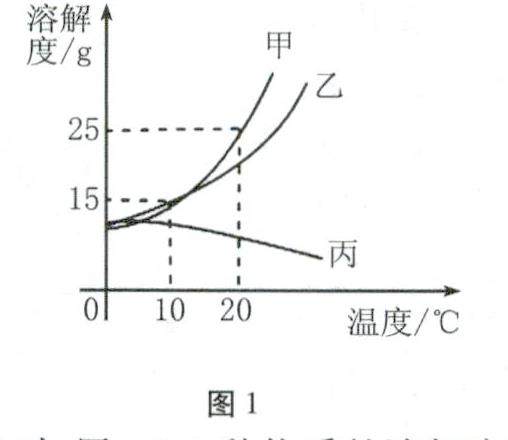
复习与练习 | 例举数形结合的几种类型
复习与练习 | 例举数形结合的几种类型















 登录
登录