目录
快速导航-

教学研究 | 让数据助推学生形成理性思维
教学研究 | 让数据助推学生形成理性思维
-

教学研究 | 基于新课程新教材的“结构课堂”的研究与构建
教学研究 | 基于新课程新教材的“结构课堂”的研究与构建
-
教学研究 | 高中化学教学中培育“科学态度与社会责任”素养的实践与思考
教学研究 | 高中化学教学中培育“科学态度与社会责任”素养的实践与思考
-

教学研究 | 学科视野导向的“氨的再认识”复习课设计
教学研究 | 学科视野导向的“氨的再认识”复习课设计
-
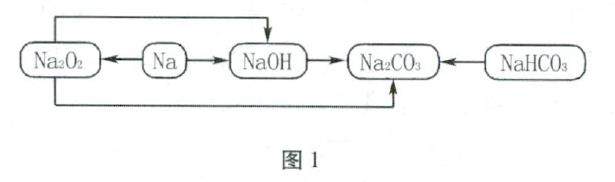
教材研究 | 人教版高中化学教材“整理与提升”栏目功能和实施建议
教材研究 | 人教版高中化学教材“整理与提升”栏目功能和实施建议
-
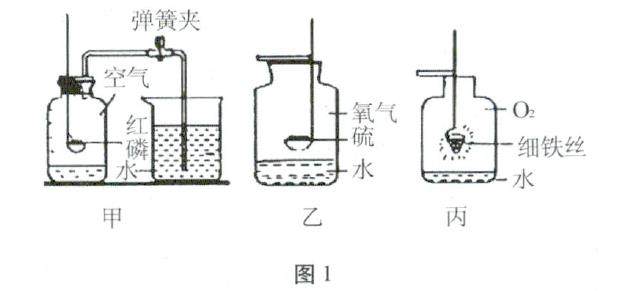
学习园地 | 多角度认识氧气
学习园地 | 多角度认识氧气
-

学习园地 | CO、CO2的性质与应用
学习园地 | CO、CO2的性质与应用
-
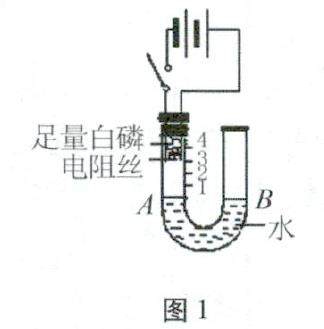
学习园地 | 例析氧气体积在空气中含量的测定
学习园地 | 例析氧气体积在空气中含量的测定
-
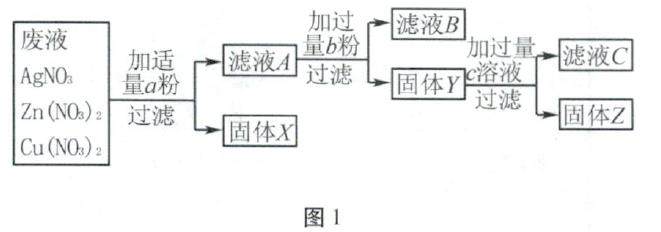
学习园地 | 盐与金属反应的规律及应用
学习园地 | 盐与金属反应的规律及应用
-

学习园地 | 盘点有机化学反应中的无机试剂
学习园地 | 盘点有机化学反应中的无机试剂
-

学习园地 | “水溶液中的离子平衡”的“不一定”
学习园地 | “水溶液中的离子平衡”的“不一定”
-

备课札记 | 纵观溶解平衡的主要考点
备课札记 | 纵观溶解平衡的主要考点
-
备课札记 | 有关“氧化还原反应”的问与答
备课札记 | 有关“氧化还原反应”的问与答
-

备课札记 | 指向“化学键”的归类考查
备课札记 | 指向“化学键”的归类考查
-

备课札记 | 剖析多平衡体系平衡常数计算的两大类型
备课札记 | 剖析多平衡体系平衡常数计算的两大类型
-

方法与技巧 | 巧用斜率快速分析图像问题
方法与技巧 | 巧用斜率快速分析图像问题
-

方法与技巧 | 不饱和度在高考有机试题分析中的应用
方法与技巧 | 不饱和度在高考有机试题分析中的应用
-
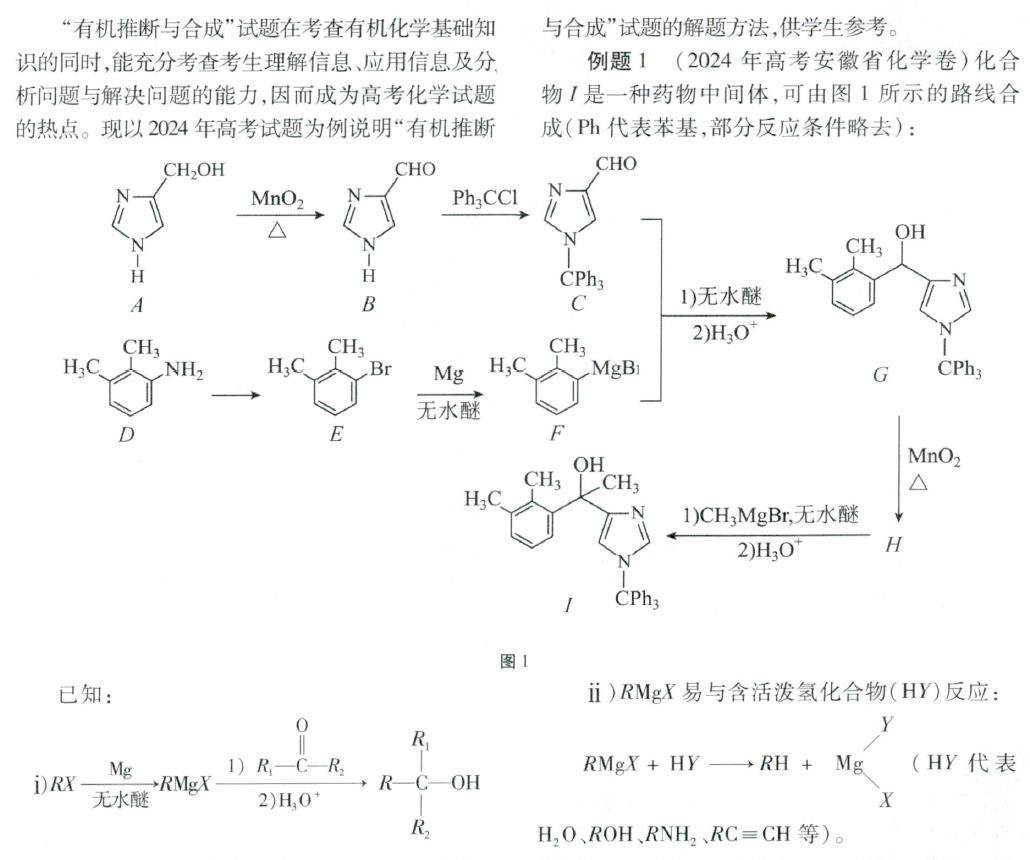
方法与技巧 | 抓住关键信息 合理进行迁移
方法与技巧 | 抓住关键信息 合理进行迁移
-

试题研究 | 2024年1月浙江化学选考试题分析
试题研究 | 2024年1月浙江化学选考试题分析
-

试题研究 | “沉淀溶解平衡与弱电解质电离平衡相互融合试题”的命题思路及解题策略
试题研究 | “沉淀溶解平衡与弱电解质电离平衡相互融合试题”的命题思路及解题策略
-

复习与练习 | 管窥“离子方程式”的考查方式
复习与练习 | 管窥“离子方程式”的考查方式
-
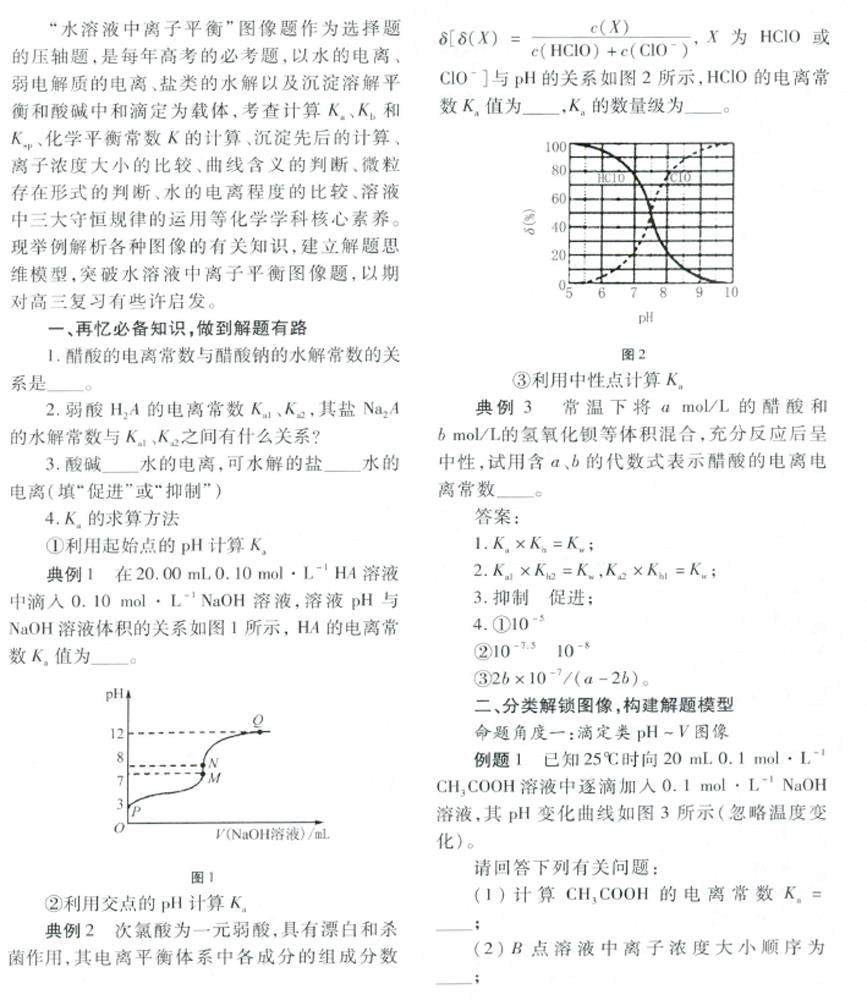
复习与练习 | “水溶液中离子平衡”图像及分析
复习与练习 | “水溶液中离子平衡”图像及分析
-

复习与练习 | 抓好“氧化还原反应基本规律”的应用
复习与练习 | 抓好“氧化还原反应基本规律”的应用
-

复习与练习 | 2024年高考“元素推断”试题解法赏析
复习与练习 | 2024年高考“元素推断”试题解法赏析
-
复习与练习 | 探索“物质结构 元素周期律”的“不一定”
复习与练习 | 探索“物质结构 元素周期律”的“不一定”















 登录
登录